În 1869, rusul Dmitri Mendeleev a făcut o descoperire remarcabilă care avea să schimbe pentru totdeauna modul în care este înțeleasă lumea substanțelor chimice. A elaborat Tabelul Periodic al Elementelor, în care a ordonat elementele chimice cunoscute la acea vreme în funcție de periodicitatea din comportamentul lor. Mai exact, Mendeleev a observat caracteristicile elementelor repetându-se la un interval periodic, în funcție de greutatea lor atomică și a concluzionat că proprietățile chimice ale elementelor sunt o funcție periodică a masei atomice. Pe baza acestei descoperiri, el a organizat elementele într-un tabel ordonat pe linii și coloane, grupându-le după proprietăți similare.
Mai mult decât atât, el a lăsat spații libere în tabel, anticipând existența unor elemente încă nedescoperite — o previziune care s-a confirmat ulterior. Tabelul lui Mendeleev s-a dovedit a fi o adevărată piatră de temelie pentru chimia modernă, facilitând înțelegerea structurii materiei și a legăturilor dintre elemente.
În acest articol vom vorbi în detaliu despre tabelul lui Mendeleev, explicând structura acestuia și de ce este considerat o descoperire revoluționară!
Ce este tabelul lui Mendeleev?
Tabelul lui Mendeleev, cunoscut oficial ca tabelul periodic al elementelor, este mult mai mult decât o simplă diagramă științifică – este harta completă a materiei din univers, organizată cu o eleganță matematică.
Definirea tabelului periodic al elementelor
Tabelul lui Mendeleev organizează toate elementele chimice cunoscute într-un sistem coerent și predictibil. Fiecare element chimic – de la hidrogen până la aur – are o poziție precisă în tabel, în funcție de numărul lor atomic, structura electronică și proprietățile chimice recurente.
Această organizare permite identificarea relațiilor dintre diferitele elemente și prezicerea comportamentului lor chimic. Elementele din același grup prezintă proprietăți chimice similare, elementele aflate în partea stângă a unei perioade fiind metale, în timp ce cele din partea dreaptă sunt nemetale.
Tabelul periodic este considerat una dintre cele mai importante realizări din istoria științei, oferind o bază solidă pentru studiul chimiei moderne.
Cine a desenat tabelul lui Mendeleev?
În 1869, în biroul său din Sankt Petersburg, chimistul Dmitri Mendeleev a realizat ceva remarcabil: a luat cele 63 de elemente cunoscute la acea vreme și le-a aranjat într-un sistem logic și coerent, bazat pe masa lor atomică și pe proprietățile chimice similare.
De ce este considerat o descoperire revoluționară
Mendeleev nu a fost primul care a încercat să clasifice elementele chimice – alți oameni de știință precum Johann Döbereiner, Alexandre-Émile Béguyer de Chancourtois și John Newlands exploraseră deja modele în proprietățile elementelor.
Totuși, elementul revoluționar al sistemului lui Mendeleev a fost modul în care a lăsat spații goale în tabelul său pentru elemente încă nedescoperite, anticipând prezența acestora și prezicând masa atomică și proprietățile lor.
Atunci când au fost decoperite noi elemente în anii 1870, care au îndeplinit mai multe dintre predicțiile lui Mendeleev, chimiștii au realizat cu adevărat importanța tabelului periodic, iar acesta a devenit nu doar un obiect de studiu, ci și un instrument de cercetare.
Citește și: Ce este pisica lui Schrödinger și ce s-a dorit cu acest experiment imaginar?
Istoria tabelului periodic – de la Mendeleev la prezent
Înainte de Mendeleev, chimiștii memorau proprietățile a sute de substanțe fără să vadă conexiuni profunde între ele – era ca și cum ai avea un dicționar imens fără nicio organizare alfabetică sau tematică.
Tabelul periodic a arătat că natura nu creează la întâmplare, ci urmează principii fundamentale care se repetă ciclic, oferind puterea de a prezice proprietățile chimice ale unui element doar știind poziția lui în tabel.
Cine a fost Dmitri Mendeleev și ce a descoperit în 1869

Dmitri Mendeleev s-a născut în micul oraș siberian Tobolsk, fiind cel mai mic dintre cei 14 copii ai lui Ivan Pavlovici Mendeleev, profesor la gimnaziul local, și ai Mariei Dmitrievna Kornileva. Tatăl său și-a pierdut vederea chiar în anul nașterii lui Dmitri și a murit câțiva ani mai târziu, în 1847. Pentru a-și întreține familia, mama sa a preluat conducerea unei mici fabrici de sticlă moștenite din familie, însă aceasta a ars complet în decembrie 1848.
Maria l-a dus pe Dmitri la Sankt Petersburg, înscriindu-l la Institutul Pedagogic Principal. La scurt timp după aceea, mama sa a murit, însă Mendeleev a absolvit în 1855 și a primit primul său post de profesor la Simferopol, în Crimeea. A predat și în Odessa, apoi s-a întors la Sankt Petersburg pentru a-și continua formarea științifică.
A obținut o diplomă de master în 1856 și a început să efectueze cercetări în chimia organică. A plecat să studieze la Universitatea din Heidelberg, finanțat printr-o bursă guvernamentală. Acolo și-a înființat un laborator în propriul apartament, a întâlnit și a stabilit contacte cu mulți dintre cei mai importanți chimiști din Europa.
În 1861, s-a întors la Sankt Petersburg unde și-a susținut teza de doctorat și a devenit profesor de chimie generală la Universitatea din Sankt Petersburg. Mendeleev a predat acolo până în 1890.
În 1869, pe când scria în lucrarea sa ”Principiile chimiei” despre elementele halogenate (clor și analogii săi), Mendeleev a comparat proprietățile acestui grup de elemente cu cele ale grupului de metale alcaline, cum ar fi sodiul și a descoperit asemănări în progresia greutăților atomice.
Treptat, a început să aranjeze elementele în ordinea greutăților lor atomice și astfel a descoperit legea periodică.
Cum a anticipat elemente încă nedescoperite
Observând că unele locuri în tabelul său organizat după periodicitate nu corespundeau niciunui element cunoscut, Mendeleev a stabilit că acolo trebuie să existe elemente încă nedescoperite. Mai mult, a avut curajul să prezică proprietățile detaliate ale acestor elemente necunoscute, bazându-se pe proprietățile vecinilor lor din tabel, ca și cum ar completa un puzzle văzând forma spațiilor goale. Predicțiile sale s-au dovedit a avea o precizie extraordinară, Mendeleev prezicându-le masa atomică aproximativă, densitatea, punctele de topire și fierbere, culoarea, reactivitatea chimică.
Aceste detalii păreau imposibile la vremea aceea, însă au fost validate ulterior, atunci când alți chimiști au descoperit alte elemente chimice (galiu, scandiu și germaniu – proprietățile acestora corespundeau cu predicțiile lui Mendeleev).
Structura tabelului lui Mendeleev
Tabelul conceput de Mendeleev este destul de diferit de versiunea modernă a tabelului periodic, cea pe care o vedem astăzi în majoritatea laboratoarelor de chimie sau în manuale. În prezent, există sute de variante ale tabelului periodic fiecare adaptată pentru scopuri educaționale, științifice sau vizuale diferite, însă toate păstrează principiul fundamental al periodicității – organizarea elementelor după numărul atomic crescător și gruparea celor cu proprietăți chimice similare pe aceeași coloană verticală.
Cum sunt grupate elementele chimice
Tabelul periodic este organizat pe două axe principale:
1. Pe orizontală, elementele sunt aranjate în perioade – șiruri numerotate de la 1 la 7 – în ordinea crescătoare a numărului atomic (numărul de protoni din nucleu). Pe măsură ce parcurgi o perioadă de la stânga la dreapta, caracterul elementelor se transformă: începi cu metale extrem de reactive, treci prin metale stabile, apoi prin nemetale și termini cu gaze nobile care sunt foarte puțin reactive.
2. Pe verticală, elementele sunt grupate în grupe sau familii – coloane numerotate care reunesc elemente cu comportament chimic similar. De exemplu, Grupa 1 conține metalele alcaline (litiu, sodiu, potasiu, rubidiu, cesiu, franciu) – toate extrem de reactive, strălucitoare și moi. Grupa 17 adună halogenii (fluor, clor, brom, iod, astat) – nemetale reactive și toxice. Această organizare reflectă structura electronică a atomilor: elementele din aceeași grupă au același număr de electroni pe învelișul exterior (electroni de valență), ceea ce le conferă reactivitate chimică similară.
În tabelul periodic modern, toate elementele sunt clasificate în blocuri, în funcție de structura lor electronică:
- Elementele blocului s – sunt elementele din primele două rânduri ale tabelului periodic. Aceste elemente includ metalele alcaline (cum ar fi litiul și sodiul) și metalele alcalino-pământoase (cum ar fi beriliul și magneziul). Aceste elemente au un electron de valență în orbitalul s.
- Elementele blocului p – sunt elementele din ultimele șase rânduri ale tabelului periodic. Aceste elemente includ nemetalele (cum ar fi hidrogenul și carbonul), metaloizii (cum ar fi siliciul și borul) și metalele de tranziție (cum ar fi titanul și cromul). Aceste elemente au un electron de valență în orbitalul p.
- Elementele blocului d – sunt elementele din cele 10 rânduri din mijloc ale tabelului periodic. Aceste elemente includ metalele de tranziție (cum ar fi fierul și cuprul). Aceste elemente au un electron de valență în orbitalul d.
- Elementele blocului f – sunt elementele din ultimele două rânduri ale tabelului periodic. Aceste elemente includ lantanoizii și actinoizii. Aceste elemente au un electron de valență în orbitalul f.
Pentru vizualizarea mai ușoară a blocurilor, versiunea modernă a tabelului periodic folosește coduri de culori diferite (roșu pentru blocul s, galben pentru blocul p, albastru pentru blocul d și verde pentru blocul f).
Ce semnifică numărul atomic, perioada și grupa
Numărul atomic – este identitatea unică a fiecărui element – numărul de protoni și electroni ai elementului. Acest număr determină totul despre un element: câți electroni gravitează în jurul nucleului, cum se aranjează acei electroni și cum se va comporta elementul în reacții chimice.
Perioada – indică pe ce rând orizontal se află elementul și numărul straturilor ocupate cu electroni. De exemplu, elementele din Perioada 1 au un singur strat de electroni, cele din Perioada 2 au două straturi, cele din Perioada 3 au trei și așa mai departe până la Perioada 7.
Grupa – indică câți electroni de valență (electronii din învelișul cel mai exterior) posedă elementul. De exemplu, elementele din Grupa 1 au un singur electron de valență pe care îl cedează ușor, în timp ce cele din Grupa 17 au șapte electroni de valență și mai au nevoie de unul pentru a completa învelișul exterior stabil. Această informație codificată în poziția din tabel permite să prezici instant cum va reacționa un element.
O grupă sau o familie de elemente este o coloană verticală din tabelul periodic. De obicei, în grupe se regăsesc proprietățile similare cele mai evidente ale elementelor, proprietățile în coloană fiind mai asemănătoare decât cele în perioadă.
Iată câteva caracteristici ale elemntelor din grupe:
- Elementele din Grupa 18 (0) sunt gaze greu de condensat.
- Metalele alcaline, din Grupa 1 (Ia), sunt solide metalice moi cu puncte de topire scăzute.
- Metalele alcalino-pământoase, din Grupa 2 (IIa), sunt mai dure și au puncte de topire mai ridicate decât metalele alcaline adiacente.
- Duritatea și punctul de topire continuă să crească în Grupele 13 (IIIa) și 14 (IVa) și apoi scad în Grupele 15 (Va), 16 (VIa) și 17 (VIIa).
- Elementele perioadelor lungi prezintă o creștere treptată a durității și a punctului de topire de la metalele alcaline inițiale până aproape de centrul perioadei, iar apoi la Grupa 16 (VIa) o scădere neregulată către halogeni și gaze nobile.
Câte perioade sunt in tabelul lui Mendeleev?
În prezent, există 7 perioade complete în tabelul lui Mendeleev, care cuprind cele 118 elemente cunoscute. Orice elemente noi vor fi plasate într-o a 8-a perioadă. Elementele sunt codificate prin diverse culori, în funcție de blocul lor: roșu pentru blocul s, galben pentru blocul p, albastru pentru blocul d și verde pentru blocul f.
Extinderea și actualizările tabelului periodic
De la publicarea sa inițială, tabelul periodic a fost extins și actualizat constant, pe măsură ce au fost descoperite noi elemente, inclusiv elementele sintetice. Actualizările moderne nu țin doar de adăugarea de elemente, ci și de rafinarea poziționării acestora, pe baza unei înțelegeri mai profunde a structurii atomice și a proprietăților lor chimice.
Câte elemente sunt în tabelul lui Mendeleev?
În prezent, tabelul periodic conține 118 elemente confirmate și oficial recunoscute, de la hidrogenul cel mai simplu (cu un singur proton) până la oganessonul complex (cu 118 protoni).
În 1869 când Mendeleev a construit tabelul periodic, acesta conținea doar 63 de elemente, atât cât erau cunoscute în acel moment.
Din cele 118 elemente din tabelul modern, primele 94 – de la hidrogen până la plutoniu – există natural pe Pământ sau în Univers, deși unele sunt extrem de rare și instabile. Elementele de la 95 (americiu) la 118 (oganesson) sunt exclusiv sintetice (create în laboratoare).
Cum s-a modificat tabelul de la versiunea originală
În schița originală a tabelului lui Mendeleev, elementele erau organizate după masa atomică crescătoare. Ulterior, chimiștii au realizat că această abordare prezenta câteva anomalii – de exemplu, telurul (masa 127.6) trebuia plasat înaintea iodului (masa 126.9) pentru ca proprietățile chimice să corespundă.
Iată cum arăta tabelul lui Mendeleev în 1871:
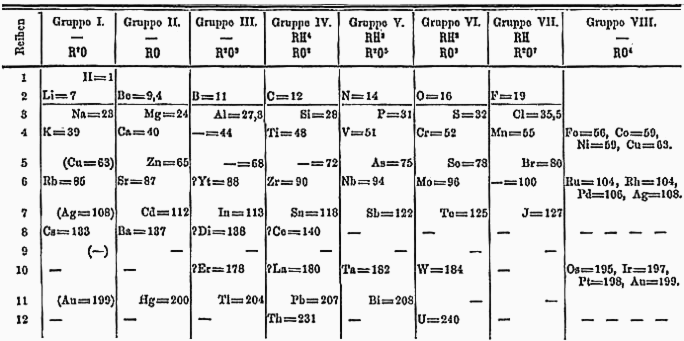
În 1913, fizicianul Henry Moseley a modificat criteriul organizatoric în tabelul periodic, de la masa atomică la numărul atomic. Această schimbare fundamentală a rezolvat toate anomaliile.
O altă modificare majoră a fost descoperirea și integrarea gazelor nobile – o întreagă familie de elemente complet necunoscută lui Mendeleev, care a necesitat adăugarea Grupei 18.
De asemenea, tabelul original era compact și liniar, iar versiunile moderne introduc blocurile (s, p, d, f) care reflectă tipul de orbital electronic și plasează lantanidele și actinidele separat pentru claritate vizuală. În plus, designul vizual modern folosește coduri de culori pentru a indica tipul de element, stările de agregare sau radioactivitatea.
Iată cum arată o variantă a tabelului periodic modern:
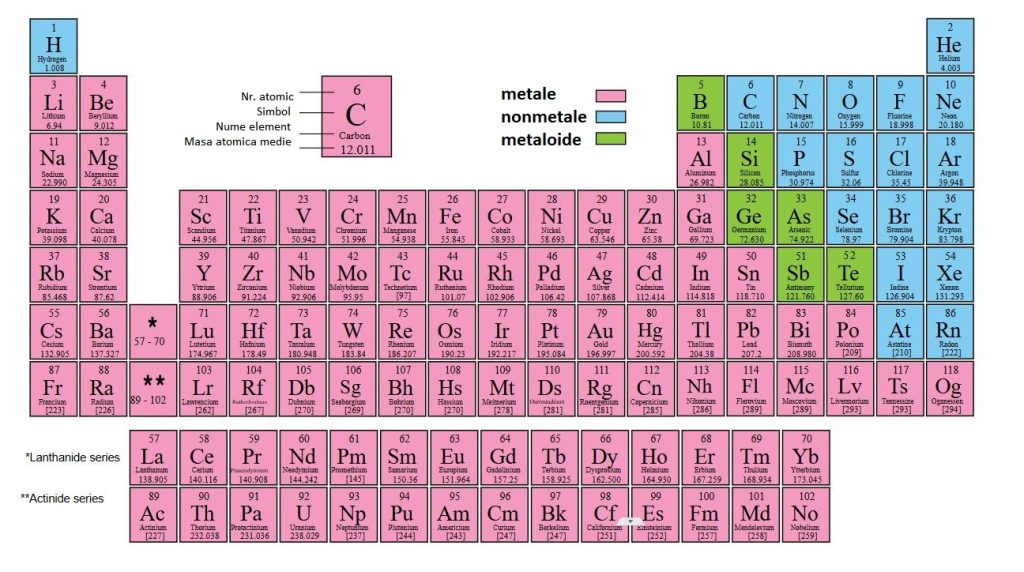
Elemente noi și sistemul IUPAC actual
Astăzi, descoperirea de elemente noi continuă, deși mult mai lent – ultimele patru elemente (nihonium-113, moscovium-115, tennessine-117 și oganesson-118) au fost oficial recunoscute în 2016.
Uniunea Internațională de Chimie Pură și Aplicată (IUPAC) este autoritatea globală care decide când un element nou este confirmat și care este numele său oficial. Procesul este riguros: echipa care revendică descoperirea trebuie să demonstreze că a creat elementul, să măsoare proprietățile sale și să dovedească că atomii conțin numărul corect de protoni. După validare, cei care au descoperit elemnetul propun un nume.
Cum înveți mai ușor tabelul lui Mendeleev?
Pentru a învăța tabelul periodic mai întâi trebuie să înțelegi structura:
- liniile orizontale (perioadele)- reprezintă straturi electronice
- coloanele verticale (grupele)- reunesc elemente cu comportament similar.
Apoi, poți învăța pe categorii:
- Grupele principale – sunt metalele alcaline (Grupa 1) foarte reactive, metalele alcalino-pământoase (Grupa 2), halogenii (Grupa 17) toxici și reactivi, gazele nobile (Grupa 18) nereactive.
- Metalele de tranziție – multe sunt familiare: fier, cupru, argint, aur, zinc.
Pentru a memora elementele, poți folosi mnemonice – adică crearea de fraze unde prima literă a fiecărui cuvânt corespunde unui element. De exemplu, pentru a învăța elementele din Perioada 2 (Li, Be, B, C, N, O, F, Ne), poți memora fraza: „Lili Belissima Bea Ceai Noaptea, Observând Frumosul Neon”.
De asemenea, folosește culorile pentru a învăța grupurile de elemente.
Nu în ultimul rând, nu uita să folosește resurse interactive – aplicații mobile, jocuri online și videoclipuri – și exersează cât mai mult. O idee este să acoperi simbolurile și apoi să le ghicești sau acoperă numele și ghicește elementul după simbol.
Utilizări moderne ale tabelului periodic
Tabelul periodic este instrumentul fundamental în fiecare laborator de chimie din lume, însă este folosit și în alte domenii, precum industrie, educație, informatică sau medicină.
În chimie, educație și industrie

În educație – este folosit pentru a studia chimia.
În cercetarea industrială – inginerii metalurgiști îl consultă când proiectează aliaje noi pentru turbine sau electronice, combinând proprietățile diferitelor metale. Specialiștii în semiconductori îl folosesc când dezvoltă procesoare.
În farmacie – chimiștii îl studiază când caută compuși medicali noi. În industria energetică – elementele au aplicații cruciale: litiul și cobaltul în baterii pentru vehicule electrice, uraniul și plutoniul în reactoare nucleare, lantanidele în turbine eoliene și panouri solare, paladiul și platina în celule de combustibil.
Fiecare progres tehnologic – de la ecrane OLED la catalizatori pentru reducerea poluării, de la implanturi medicale la sticlă ultra-rezistentă – se bazează pe înțelegerea proprietăților elementelor, informații codificate în tabelul periodic.
În informatică – computerele cuantice experimentează cu diferiți atomi; stocarea de date explorează înregistrarea la nivel atomic.
În medicină – înțelegerea elementelor este vitală: magneziul, calciul și potasiul reglează funcții biologice esențiale; deficiențele de fier, zinc sau seleniu cauzează boli; elementele radioactive precum iod-131 sunt folosite în tratarea cancerului; elementele de contrast permit imagistica medicală.
De ce este încă esențial în știința modernă
Deși desenat în 1869, tabelul periodic rămâne absolut indispensabil pentru că descrie structura fundamentală a materiei la nivel atomic. Totul din universul fizic – de la proteine până la planete – este construit din aceste 118 elemente.
El permite oamenilor de știință să prezică proprietăți, reacții și comportamente chimice pe baza poziției unui element, facilitând descoperirea de noi materiale — de la semiconductori folosiți în tehnologia computerelor, până la catalizatori în industria auto, dar și dezvoltarea de noi medicamente sau tehnologii. Oamenii de știință din diverse domenii se uită la poziția unui element în tabelul periodic pentru a cunoaște reacțiile și combinațiile posibile cu alte elemente.
Nu în ultimul rând, tabelul periodic conectează chimia cu fizica și biologia, fiind un reper fundamental pentru înțelegerea structurii materiei și a proceselor care susțin viața.
Curiozități despre tabelul lui Mendeleev
Deși la început ideile lui Mendeleev au fost întâmpinate cu scepticism, odată cu descoperirea noilor elemente prevăzute în tabel, lucrarea lui a devenit una dintre cele mai mari realizări din istoria științei.
Previziuni corecte și mituri interesante
Iată câteva curiozități interesante despre tabelul lui Mendeleev:
1. Mendeleev a prezis existența și proprietățile unor elemente complet necunoscute în momentul creării tabelului periodic. Ele le-a numit atunci ”eka-aluminium”, „eka-bore” și „eka-silicon”:
- Eka-aluminium a fost descoperit mai târziu și a fost numit galiu. Pentru acest element, Mendeleev, a prezis masa atomică aproximativ 68 (real: 69.7), densitate 5.9 g/cm³ (real: 5.9), punct de topire jos și reacții cu acizi și baze – toate confirmate.
- Eka-silicon a fost denumit germanium când a fost descoperit, iar pentru acesta Mendeleev a prezis masa 72 (real: 72.6), densitatea 5.5 (real: 5.3), culoarea cenușie și formarea oxidului GeO₂ – toate corecte.
- Eka-bore a fost numit scandiu, iar pentru el Mendeleev a prezis masa atomică (aproximativ 44 față de reală: 44.96), densitatea (aproximativ 3.5 g/cm³ față de scandiu real: 2.99 g/cm³), culoarea: gri-alb și formarea unui oxid de tip Eb₂O₃ (scandiul real formează Sc₂O₃).
2. Mitul visului. Există o legendă că Mendeleev a visat tabelul periodic complet după trei zile fără somn. Realitatea este că a lucrat ani de zile la clasificare, experimentând cu sute de aranjamente. Visul, dacă a existat, a fost un moment de clarificare după muncă intensă, nu o revelație spontană.
3. Scepticismul lui Mendeleev. Chimistul rus a fost sceptic față de gazele nobile când au fost descoperite, deoarece nu se potriveau în schema sa, dar a fost convins prin dovezi să le adauge pe tabelul său.
4. Controversa Nobel. Deși a fost nominalizat de multe ori, Mendeleev nu a primit niciodată Premiul Nobel. Aceasta a fost considerată una dintre cele mai mari omisiuni în istoria premiului.
5. Element omagiu. Elementul 101, mendeleeviu (Md), a fost numit în cinstea sa în 1955.
Așadar, tabelul periodic al lui Mendeleev rămâne una dintre cele mai importante descoperiri din istoria științei. Conceput acum peste 150 de ani a rezistat testului timpului și a evoluat continuu, dar structura sa fundamentală bazată pe periodicitate rămâne neschimbată. În prezent, tabelul periodic este mai mult decât un simplu instrument de clasificare, este o hartă a materiei care ghidează cercetarea modernă în domenii variate, de la dezvoltarea de noi materiale și medicament până la explorarea spațială și tehnologii verzi.
Surse articol: Origins.osu.edu, Mendeleev.com/, Britannica.com, Wikipedia.org, Thoughtco.com













